του Ιωάννη Καραφύλλη, Ph.D *, medlabnews.gr
Η ελληνική φαρμακοβιομηχανία είναι γνωστό ότι αποτελεί το βασικό πυλώνα ανάπτυξης της Ελλάδος και στην πραγματικότητα είναι ο πρώτος εξαγωγικός κλάδος της ελληνικής οικονομίας δημιουργώντας μια σημαντική εγχώρια προστιθέμενη αξία και συμβάλλοντας τα μέγιστα στην οικονομία και την απασχόληση στη χώρα μας.
Οι ελληνικές φαρμακευτικές επιχειρήσεις είναι γνωστό ότι εξάγουν σε 139 χώρες.
Το 99% των εξαγωγών τους καλύπτει χώρες που άμεσα ή το αργότερο μέχρι το 2019 θα έχουν υιοθετήσει τον νέο ευρωπαϊκό κανονισμό (161/2016 της Ε.Ε). Η Ελλάδα ζήτησε και πήρε παράταση για την εφαρμογή του κανονισμού αυτού μέχρι το 2021.
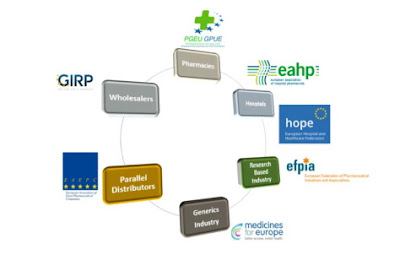
Ο ευρωπαϊκός κανονισμός έθεσε το πλαίσιο για την πρόληψη της εισόδου ψευδεπίγραφων φαρμάκων στη νόμιμη αλυσίδα εφοδιασμού και η εφαρμογή του απαιτεί μια end-to-end επαλήθευση, παρακολούθηση και εντοπισμό των φαρμάκων γεγονός που συνεπάγεται διαφορετικές ευθύνες-υποχρεώσεις για τα διαφορετικά στάδια της εφοδιαστικής αλυσίδας. Τα στάδια αυτά είναι:
- Παραγωγοί φαρμάκων
- Έμποροι Παράλληλης Διακίνησης (ή σε περίπτωση επανασυσκευασίας ή επανασήμανσης)
- Αντιπρόσωποι-Χονδρέμποροι
- Φαρμακεία
- Πολιτεία
Όπως φαίνεται και από το σχήμα παρακάτω στην λήψη της απόφασης συμμετείχαν όλοι οι εμπλεκόμενοι στην παραγωγή και διακίνηση του φαρμάκου. Όποιες λοιπόν ενστάσεις, ως προς την λειτουργία και το κόστος του, τίθενται σήμερα στην Ελλάδα δεν μπορούν να έχουν κάποιο αντίκρισμα ή πιθανή συζήτηση σε ευρωπαϊκό επίπεδο.
Πηγή:EMVO European Medicines Verification System 2017
Η ποικιλία των νόμων και των προτύπων στην παγκόσμια φαρμακευτική αγορά απαιτεί διαφορετικές πληροφορίες serialization για διαφορετικές χώρες. Αυτές οι πληροφορίες είναι πιθανό να περιλαμβάνουν αρκετά από τα παρακάτω:
- Συνεπείς αποδείξεις προέλευσης σε όλη την αλυσίδα εφοδιασμού, από τον κατασκευαστή μέχρι να παραδοθούν τα φάρμακα στους ασθενείς
- Λεπτομερείς πληροφορίες για κάθε εταιρεία (π.χ. όνομα, διεύθυνση, ημερομηνία παραγωγής, αριθμός παρτίδας) πιστοποίηση των συνταγογραφούμενων φαρμάκων
- Ονομασία του συνταγογραφούμενου φαρμάκου, ποσότητα, μορφή, ισχύ και δοσολογία
- Ημερομηνία κάθε συναλλαγής στην αλυσίδα διανομής
- Αριθμός τιμολογίου πωλήσεων κάθε συναλλαγής
- Αριθμός πακέτων σε κάθε συναλλαγή
- Αριθμοί παρτίδας / μερίδας και ημερομηνία λήξης
- Πλήρεις πληροφορίες αποστολής
- Δήλωση ορθότητας και αλήθειας των πληροφοριών σε κάθε στάδιο, κ.ά.
Η συνέχιση της συνεργασίας μεταξύ μεγάλων φαρμακευτικών βιομηχανιών και των CMOs , θα επιβαρύνει τους δεύτερους οποίοι θα επωμισθούν κυρίως το κόστος αυτών των σημαντικών αλλαγών και μάλιστα άμεσα.
Κάθε ευρωπαϊκή χώρα (της Ευρωπαϊκής Ένωσης, του Ευρωπαϊκού Οικονομικού Χώρου και της Ελβετίας) πρέπει να εφαρμόσει ένα Εθνικό Σύστημα Επαλήθευσης των Φαρμάκων (NMVS) το οποίο θα συσταθεί και θα διαχειρίζεται ένας Εθνικός Οργανισμός Επαλήθευσης Φαρμάκων (NMVO).
Ο κύριος σκοπός του NMVS είναι να χρησιμεύσει ως πλατφόρμα επαλήθευσης ότι τα φαρμακεία ή άλλα εγγεγραμμένα μέρη – όπως οι χονδρέμποροι, οι αυτοεξυπηρετούμενοι (self-dispensing) ιατροί ή τα φαρμακεία των νοσοκομείων – θα το χρησιμοποιήσουν για να ελέγξουν την αυθεντικότητα ενός προϊόντος.
Οι κύριοι στόχοι ενός NMVS είναι:
• Η διατήρηση των σχετικών στοιχείων serialization των προϊόντων για την εθνική αγορά.
• Η λήψη αναθεωρημένων / νέων δεδομένων serialization των προϊόντων από το EU-Hub.
• Η εξυπηρέτηση ως πλατφόρμα επαλήθευσης για τα φαρμακεία ή άλλα εγγεγραμμένα μέρη, όπως οι χονδρέμποροι – φαρμακαποθήκες και τα νοσοκομεία, για να πιστοποιήσουν την αυθεντικότητα ενός προϊόντος.
• Η εξυπηρέτηση ως πλατφόρμα για τους χονδρεμπόρους – φαρμακαποθηκαρίους στην περίπτωση εφαρμογής από το κράτος μέλος του άρθρου 23 του κατ’εξουσιοδότηση κανονισμού (ΕΕ) 2016/161, για να επισημαίνεται μια συσκευασία προϊόντος ως απενεργοποιημένη πριν την παραδώσει στον ασθενή.
• Εξυπηρέτηση ως πλατφόρμα για τους χονδρεμπόρους να χαρακτηρίζουν μια συσκευασία προϊόντος ως » απενεργοποιημένη » π.χ. «Εξάγονται εκτός ΕΕ
Ο κύριος σκοπός του NMVS είναι να χρησιμεύσει ως πλατφόρμα επαλήθευσης ότι τα φαρμακεία ή άλλα εγγεγραμμένα μέρη – όπως οι χονδρέμποροι, οι αυτοεξυπηρετούμενοι (self-dispensing) ιατροί ή τα φαρμακεία των νοσοκομείων – θα το χρησιμοποιήσουν για να ελέγξουν την αυθεντικότητα ενός προϊόντος.
Οι κύριοι στόχοι ενός NMVS είναι:
• Η διατήρηση των σχετικών στοιχείων serialization των προϊόντων για την εθνική αγορά.
• Η λήψη αναθεωρημένων / νέων δεδομένων serialization των προϊόντων από το EU-Hub.
• Η εξυπηρέτηση ως πλατφόρμα επαλήθευσης για τα φαρμακεία ή άλλα εγγεγραμμένα μέρη, όπως οι χονδρέμποροι – φαρμακαποθήκες και τα νοσοκομεία, για να πιστοποιήσουν την αυθεντικότητα ενός προϊόντος.
• Η εξυπηρέτηση ως πλατφόρμα για τους χονδρεμπόρους – φαρμακαποθηκαρίους στην περίπτωση εφαρμογής από το κράτος μέλος του άρθρου 23 του κατ’εξουσιοδότηση κανονισμού (ΕΕ) 2016/161, για να επισημαίνεται μια συσκευασία προϊόντος ως απενεργοποιημένη πριν την παραδώσει στον ασθενή.
• Εξυπηρέτηση ως πλατφόρμα για τους χονδρεμπόρους να χαρακτηρίζουν μια συσκευασία προϊόντος ως » απενεργοποιημένη » π.χ. «Εξάγονται εκτός ΕΕ
Στο πλαίσιο του κανονισμού για τα ψευδεπίγραφα (FMD), οι Κάτοχοι Αδείας Κυκλοφορίας (ΚΑΚ) καλούνται να χρηματοδοτήσουν τη ρύθμιση και τη λειτουργία του EMVS, συμπεριλαμβανομένων των επιμέρους NMVS. Κάθε ΚΑΚ που διαθέτει στο εμπόριο τουλάχιστον ένα προϊόν εντός εθνικής επικράτειας πρέπει να συνάπτει σύμβαση με το σχετικό NMVO. Αυτά τα κόστη είναι πιθανό να περιλαμβάνουν μια «one off» συνένωση (π.χ. εισιτήριο εισόδου) για κάθε περιοχή στην οποία ο ΚΑΚ είναι πρόθυμος να διαθέσει τα προϊόντα του και ένα συνεχές ετήσιο τέλος συνδρομής, το οποίο θα καλύψει τις λειτουργικές δαπάνες των NMVS . Επιπλέον, οι χονδρέμποροι και οι διανομείς αλυσίδας εφοδιασμού, π.χ. τελικοί χρήστες, θα πρέπει να συνδεθούν με τα σχετικά NMVS. Αυτό θα επιτρέψει την επαλήθευση από απόσταση και τον έλεγχο ταυτότητας των φαρμάκων εντός της επικράτειας του ΝΜVO.
Πηγή:EMVO European Medicines Verification System 2017
Η δημιουργία και η διαχείριση του εθνικού συστήματος αποθετηρίου είναι ένας πάρα πολύ σημαντικός παράγοντας που θα πρέπει να εξασφαλίζεται από τους ΚΑΚ, δεδομένου ότι είναι υπεύθυνοι για τη διάθεση του προϊόντος στην αγορά, καθώς και από τους παρασκευαστές των φαρμάκων που φέρουν τα χαρακτηριστικά ασφαλείας, αφού εκείνοι αναλαμβάνουν το κόστος του συστήματος αποθετηρίων σύμφωνα με το κανονισμό. Ωστόσο, οι χονδρέμποροι και τα πρόσωπα που έχουν άδεια ή είναι εξουσιοδοτημένα να διαθέτουν φάρμακα στο κοινό θα πρέπει να έχουν το δικαίωμα να συμμετέχουν στη δημιουργία και τη διαχείριση του συστήματος αποθετηρίων, αν το επιθυμούν, αφού η καθημερινή εργασία τους θα εξαρτάται από την ορθή λειτουργία αυτού του συστήματος. Επιπλέον, θα πρέπει να ζητηθεί η γνώμη των αρμόδιων εθνικών αρχών σχετικά με τη δημιουργία του συστήματος αποθετηρίων, δεδομένου ότι η έγκαιρη συμμετοχή τους θα ωφελήσει τις επακόλουθες δραστηριότητες εποπτείας.
Το αποθετήριο εμπεριέχει άμεσους επιχειρηματικούς κινδύνους και κόστη. Υπάρχουν επίσης μερικές λεπτές ανησυχίες. Τι θα συμβεί αν το σύστημα αριθμού αποθετηρίων είναι αναξιόπιστο; Ο NMVO θα είναι υπεύθυνος για να τρέξει το σύστημα ελέγχου των δεδομένων στη χώρα μας. Υπάρχουν ήδη προ-εγκεκριμένοι πάροχοι τεχνολογίας που συναγωνίζονται για αυτή την δραστηριότητα και τους επόμενους μήνες αναμένεται η ολοκλήρωση της δημιουργίας της στις περισσότερες χώρες.
Ο αντίκτυπος για τους διανομείς και τους κατασκευαστές θα είναι σοβαρός εάν το εθνικό σύστημα εφαρμόζεται ελλειπώς, αργά, είναι επιρρεπές σε λάθη και είναι αργό ή δύσκολο να χρησιμοποιηθεί από τους φαρμακοποιούς. Αν υπάρχει μεγάλος αριθμός πακέτων-συσκευασιών που επιστρέφονται πίσω λόγω αστοχίας του συστήματος, τότε θα παρουσιαστεί μια σημαντική πρόσθετη επιβάρυνση του κόστους.
Επιπλέον άτομα και συστήματα θα χρειαστεί να εργαστούν για να προσδιορίσουν εκ νέου τα δεδομένα ώστε τα προϊόντα να γίνουν εμπορεύσιμα και πάλι. Για τους κατασκευαστές οι οποίοι δεν θα έχουν aggregating κατά τη διάρκεια της παραγωγής, ακόμη και να πάρουν μια ολόκληρη, αρχική, χωρίς να έχει ανοιχτεί παλέτα ή περίπτωση αποστολέα που την επιστρέφει πίσω, θα σημάνει το σπάσιμο της συσκευασίας στο επίπεδο της μονάδας, τον έλεγχο των κωδικών, εκ νέου συσκευασία, κ.λπ.
Αυτό σημαίνει ότι η βιομηχανία θα πρέπει να εμπλακεί στενά με τη διαδικασία επιλογής του NMVO (είτε απευθείας, είτε μέσω του επαγγελματικού της συνδέσμου) στις χώρες στις οποίες δραστηριοποιείται. Στην πραγματικότητα λοιπόν το αποθετήριο αφορά όλους τους εμπλεκόμενους και για αυτό οι απαιτούμενες ενέργειες πρέπει να γίνουν έγκαιρα, ταυτόχρονα και συντονισμένα. Εάν αυτό δεν συμβεί τότε το κόστος θα είναι πολλαπλάσιο για όλους.
Αυτό σημαίνει ότι η βιομηχανία θα πρέπει να εμπλακεί στενά με τη διαδικασία επιλογής του NMVO (είτε απευθείας, είτε μέσω του επαγγελματικού της συνδέσμου) στις χώρες στις οποίες δραστηριοποιείται. Στην πραγματικότητα λοιπόν το αποθετήριο αφορά όλους τους εμπλεκόμενους και για αυτό οι απαιτούμενες ενέργειες πρέπει να γίνουν έγκαιρα, ταυτόχρονα και συντονισμένα. Εάν αυτό δεν συμβεί τότε το κόστος θα είναι πολλαπλάσιο για όλους.
Οι ελληνικές φαρμακευτικές βιομηχανίες σε μια εξαιρετικά δύσκολη οικονομική συγκυρία , υπερβάλλοντας και ξεπερνώντας τις όποιες αντιξοότητες και δυσκολίες εγκατέστησε τον απαιτούμενο εξοπλισμό σε αρκετές γραμμές παραγωγής προκειμένου να αντιμετωπίσει και αυτή την πρόκληση. Όμως δεν έχει ξεκινήσει καν η συζήτηση για την δημιουργία του NMVO εκτιμώντας ότι είναι αρκετά νωρίς σε σχέση με το 2021.
Αρκετές βιομηχανίες πιστεύουν ότι θα μπορέσουν να εγγραφούν στον NMVO μιας άλλης χώρας προκειμένου να ξεπεράσουν την μη ύπαρξη του στην Ελλάδα. Αυτό όμως εγκυμονεί σοβαρούς κινδύνους τόσο λειτουργικούς όσο και οικονομικούς. Π.χ κάθε μια χώρα μπορεί να έχει άλλες απαιτήσεις για την περιεχομένη πληροφορία στο 2D-code ενώ ακόμα δεν έχει διευκρινιστεί εάν για να κυκλοφορήσει ένα φάρμακο με αυτή την παράπλευρη διαδικασία πρέπει να καταβάλει τέλη εισόδου σε κάθε έναν NMVO. Σχεδόν οι περισσότερες χώρες της Ευρωπαϊκής Ένωσης έχουν αναπτύξει το δικό τους NMVO.
Σε λίγους μήνες θα γίνει η δοκιμαστική λειτουργία του συστήματος πανευρωπαϊκά απούσης της Ελλάδος. Αυτό εγκυμονεί κινδύνους για τις αποφάσεις που θα ληφθούν από όλες τις υπόλοιπες συμμετέχουσες χώρες και την συμμόρφωση της Ελλάδος μ’ αυτές κατά τη μεταγενέστερη λειτουργία του ελληνικού NMVO.
Είναι εμφανές λοιπόν ότι όχι μόνο απαιτείται από την ελληνική φαρμακοβιομηχανία άμεσα όχι μόνο το διαβατήριο (serialization) αλλά και η σύσταση και λειτουργία του NMVO προκειμένου ν’ αξιοποιηθούν οι σημαντικές δυνατότητες και επενδύσεις της ελληνικής φαρμακοβιομηχανίας.
 Ιατρικά Νέα Θέματα για την υγεία | Το εγκυρότερο ελληνικό portal με θέματα υγείας, διατροφής, ομορφιάς, φυσικής κατάστασης, ιατρικών θεμάτων
Ιατρικά Νέα Θέματα για την υγεία | Το εγκυρότερο ελληνικό portal με θέματα υγείας, διατροφής, ομορφιάς, φυσικής κατάστασης, ιατρικών θεμάτων